生化领域常用的几种缓冲溶液及配制方法
缓冲溶液一般是由溶度较大的弱碱(或弱酸)及其共轭酸(或共轭碱)组成,可通过弱酸解离平衡的移动达到消耗掉外来少量强酸、强碱,或对抗稍加稀释的作用,使溶液pH值不发生明显的变化,在科研工作、工业生产以及一切生命过程中,都是非常重要的。本文将对生化实验中常用的缓冲溶液及配制方法进行简单的介绍。
PB和PBS缓冲溶液
PB和PBS是生化实验中为常用的缓冲液,0.1mol/L的磷酸盐缓冲液(PB)常用于配制固定液、蔗糖等;0.01mol/L的磷酸盐缓冲生理盐水(PBS)主要用于漂洗组织标本、稀释血清等,其pH应在7.25~7.35之间。
1.磷酸盐缓冲液(Phosphate Buffer, PB)
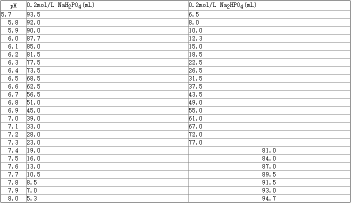
配制时,常先配制0.2mol/L的 NaH2PO4和0.2mol/L的Na2HPO4,两者按一定比例混合即成0.2mol/L的磷酸盐缓冲液(PB),根据需要可配制不同浓度的PB(见表1)。
2.磷酸盐缓冲生理盐水(Phosphate Buffered Saline, PBS)
称取NaCl 8.5~9g及0.2mol/L的PB 50mL,加入1000mL的容量瓶中,后加重蒸水至1000mL,充分摇匀即可得到0.01mol/L的PBS。一般情况下,0.2mol/L PB的pH值稍高些,稀释成0.01mol/L的PBS时,常可达到要求的pH值,如果需要调整,通常通过调整PB的pH来实现。
表1. 0.2mol/L磷酸盐缓冲液(pH5.7~8.0)
Tris缓冲溶液
Tris缓冲液除被广泛用作核酸和蛋白质的溶剂外,还被用于不同pH条件下的蛋白质晶体生长和线虫核纤层蛋白中间纤维的形成,同时也是蛋白质电泳缓冲液的主要成分之一。
1.Tris-HCl缓冲液
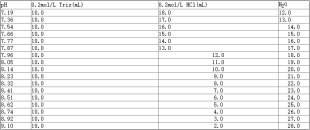
生化实验中常用的Tris-HCl缓冲液浓度为0.05mol/L,pH=7.6,主要用于配制Tris缓冲生理盐水(TBS)、DAB显色液。配制时,先以少量重蒸水(300~500mL)溶解60.57g Tris,加入HCl后,用1N的HCl或1N的NaOH将pH调至7.6,后加重蒸水至1000mL,得储备液,于4℃冰箱中保存。用时取储备液稀释10倍即可(见表2)。
表2.0.05mol/L Tris-HCl缓冲液(pH7.19~9.10)
2.Tris缓冲生理盐水(Tris Buffered Saline,TBS)
TBS主要用于漂洗标本,常用于免疫酶技术中。先以重蒸水少许溶解3.5~9g NaCl,再加0.5mol/L Tris-HCl缓冲液 100mL,后加重蒸水至1000mL,充分摇匀使Tris终浓度为0.05mol/L。
3.Tris-TBS (PBS)
常用浓度为1%和0.3%,1%Tris-TBS主要用于漂洗标本,3%Tris-TBS主要用于稀释血清。先以重蒸水少许溶解8.5~9g NaCl后,加入10mL (1%)或3mL (0.3%) Triton X-100及0.5mol/L Tris缓冲液1000mL(50mL)或(0.2mol/L的PB),后加重蒸水至1000mL,充分摇匀。
二甲胂酸缓冲液
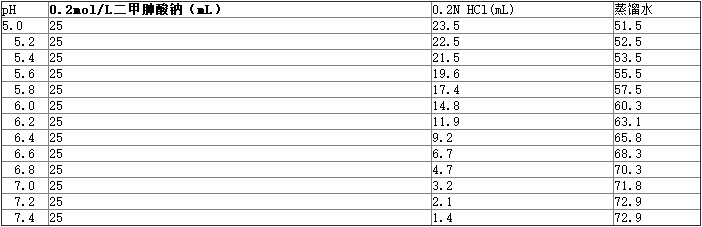
先称取二甲胂酸钠(MW:214)42.8g,加蒸馏水至1000mL,获得0.2mol/L的二甲胂酸钠溶液;再取HCl 1.7mL加蒸馏水至1000mL ,配成0.1N,后取0.2mol/L二甲胂酸钠溶液500mL及0.1N HCl 28mL混合,加蒸馏水至1000mL,即为0.1mol/L的二甲胂酸钠缓冲液。不同pH值的配制方法见表3。
表3.0.1mol/L二甲胂酸钠缓冲液(pH5.0~7.4)
HEPES缓冲溶液
HEPES是一种非离子两性缓冲液,其在pH 7.2~7.4 范围内具有较好的缓冲能力,常用在生化诊断试剂盒、DNA/RNA提取试剂盒及PCR诊断试剂盒里,其大优点是在开放式培养或细胞观察时能维持较恒定的PH值,并对细胞无毒性作用。使用终浓度为10~50mmol/L。关于HEPES 缓冲溶液的配制,根据用途,有以下几种方法:
(1)119.15 g HEPES 溶解在400mL蒸馏水中,加0.5~1M 的NaOH水溶液调节至少所需pH,然后用蒸馏水定容至500mL,得1 M HEPES, pH = 7.0,于4°C保存;
(2) HEPES 6.5g、NaCl 8.0g、Na2HPO4·7H2O 0.198g、用0.5M NaOH 水溶液调节pH值,后定容;
(3)将1.6g NaCl、0.074g KCl、0.027g Na2HPO4·2H2O、0.2g葡聚糖和1g HEPES溶解在90mL的蒸馏水,用0.5M NaOH调节至所需pH值,再用蒸馏水定容至100mL即可。
MOPS
MOPS Buffer,即3-吗啉丙磺酸缓冲液,属于生物缓冲剂,可作为二维凝胶电泳中等电聚焦电泳(IEF)的电解质系统成分;还可应用于Northern杂交,作为RNA的分离和转膜时的缓冲液。常用的10×MOPS Buffer配制方法如下:
(1)称量41.8 g MOPS,溶解于约700mL DEPC处理水中;
(2)使用2 N NaOH 调节pH值至7.0;
(3)向溶液中加入DEPC处理的1M NaOAC 20mL、0.5M EDTA(pH8.0) 20mL;
(4)定容至1 L,用0.45 μm 滤膜过滤除去杂质,室温避光保存。
缓冲溶液在科研、医学、工农业中都有及其广泛的应用,研究工作的溶液体系pH值的变化往往会直接影响到研究工作的成效。在选择和配制缓冲溶液时,要(1)选择合适的缓冲系,确定pH位于缓冲范围内,并且不干扰主反应;(2)有较好的缓冲能力,使缓冲体系有较大的缓冲容量;(3)浓度合适:总浓度过低,缓冲容量过小,总浓度过高,渗透压过大。配制出合适的缓冲溶液,才能够达到预期的实验目的。
来源:上海远慕生物科技有限公司

